O que é o colesterol?
O colesterol é um assunto que muita gente já ouviu falar, mas poucos são aqueles realmente estão esclarecidos sobre o tema. Quem nunca ouviu falar sobre os termos: colesterol bom e ruim, HDL, LDL, VLDL e triglicerídeos e dislipidemia?
Somos bombardeados diariamente com informações de todo o tipo sobre o colesterol. Siglas que não fazem sentido e valores são frequentemente atirados sobre os pacientes sem que este receba o mínimo de orientação para poder aproveitar tanta informação disponível.
PUBLICIDADE / PUBLICIDAD
O colesterol é uma substância gordurosa encontrada em todas as células no nosso corpo. Ele é essencial para a formação das membranas das nossas células, para a síntese de hormônios, como a testosterona, estrogênio, cortisol e outros, para a produção da bile, para digestão de alimentos gordurosos, para formação da mielina (uma bainha que cobre os nervos), para metabolização de algumas vitaminas (A, D, E e K), etc.
O colesterol do nosso organismo tem duas origens:
- Endógena: produzido pelo nosso próprio corpo, principalmente pelo fígado.
- Exógena: adquirido através dos alimentos.
Tipos de colesterol
Como se trata de uma substância gordurosa, o colesterol não se dissolve no sangue, da mesma forma que gotas de óleo não se dissolvem na água. Portanto, para viajar através da corrente sanguínea e alcançar os tecidos periféricos, o colesterol precisa de um transportador. Essa função cabe às lipoproteínas que são produzidas no fígado. As principais são:
- VLDL (Very low-density lipoprotein).
- LDL (Low-density lipoprotein).
- HDL ( High-density lipoprotein).
O LDL transporta colesterol e um pouco de triglicerídeos do sangue para os tecidos. O VLDL transporta triglicerídeos e um pouco de colesterol. Já o HDL é um transportador diferente, ele faz o caminho inverso, tira colesterol dos tecidos e devolve para o fígado que vai excretá-lo nos intestinos.
Portanto, enquanto o LDL e o VLDL levam colesterol para as células e facilitam a deposição de gordura nos vasos, o HDL faz o inverso, promove a retirada do excesso, inclusive das placas arteriais. Por isso, denominamos o HDL como “colesterol bom” e o VLDL e o LDL como “colesterol ruim”.
O colesterol derivado de gorduras saturadas e gordura trans favorece a produção de LDL, enquanto o consumo de gorduras insaturadas, encontrada no azeite, peixes e amêndoas, por exemplo, promovem a produção do HDL.
Portanto, ao dosarmos os valores das lipoproteínas transportadoras LDL, VLDL e HDL temos uma avaliação indireta da quantidade e da qualidade do colesterol que circula em nosso sangue. Por isso, o lipidograma, exame usado para dosar as lipoproteínas, é usado para avaliarmos os níveis de colesterol sanguíneos.
O que é o Colesterol IDL?
O IDL (Intermediatelow-density lipoprotein) é um tipo de colesterol semelhante ao LDL. Como tem efeitos semelhantes, ele não é normalmente dosado individualmente, mas sim junto com o LDL. Portanto, quando recebemos o valor do LDL, habitualmente estamos falando do valor de LDL + IDL.
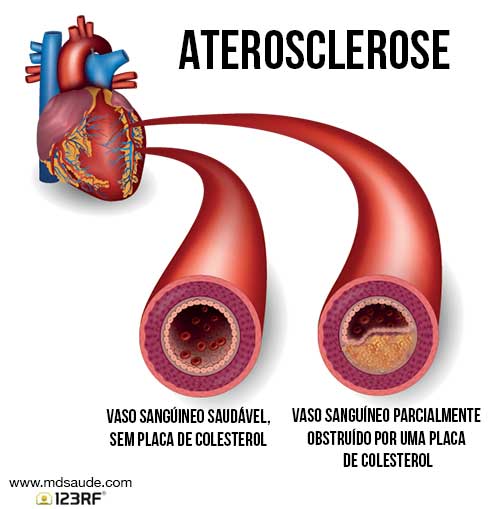
O que é aterosclerose?
Elevadas concentrações de VLDL e o LDL estão associados à deposição de gordura na parede dos vasos sanguíneos, levando à formação de placas. Quando nosso corpo tem mais colesterol do que precisa, as moléculas de LDL ficam circulando no sangue à procura de algum tecido que esteja precisando de colesterol para o seu funcionamento. Se esse colesterol não for entregue a nenhum tecido, a molécula de LDL acaba se depositando dentro da parede dos vasos sanguíneos, acumulando gordura no mesmos. Este processo é chamado de aterosclerose
Veja na ilustração acima como essas placas de gordura ocupam espaço e diminuem o diâmetro da luz dos vasos (chamamos de luz a parte oca de dentro dos vasos por onde passa o sangue). A aterosclerose também causa lesão direta na parede, diminuindo a elasticidade das artérias, tornando-as mais duras.
O depósito de gordura e a lesão da parede dos vasos favorecem a obstrução do fluxo de sangue e a redução do aporte de oxigênio e nutrientes aos tecidos. Quando os vasos acometidos pelas placas ateromatosas são as artérias coronárias (artérias do coração), o resultado final pode ser um quadro de angina ou de infarto cardíaco. Da mesma forma, quando são acometidos vasos cerebrais, o paciente pode evoluir com um AVC, que é um infarto do cérebro.
PUBLICIDADE / PUBLICIDAD
Dislipidemia
O aumento dos níveis de colesterol é chamado de dislipidemia. Durante muito tempo os médicos avaliaram o grau de dislipidemia através do valor do colesterol total, que nada mais é do que a soma dos níveis sanguíneos de HDL + LDL + VLDL. Porém, como acabamos de explicar, há o colesterol ruim e bom, o que torna pouca eficiente a avaliação conjunta deles. Atualmente o valor total é menos valorizado do que os níveis individuais de HDL e LDL.
Veja esses exemplos:
- Paciente 1 – LDL 150, HDL 20 e VLDL 20 = colesterol total de 190.
- Paciente 2 – LDL 100, HDL 65 e VLDL 25 = colesterol total de 190.
Pelo que foi explicado até agora, não há dúvidas que o paciente 1 apresenta mais riscos de aterosclerose que o paciente 2, apesar de terem o mesmo nível de colesterol total. O exemplo acima explica o porquê do valor total não ser o melhor parâmetro para avaliar a dislipidemia.
Valores de colesterol HDL e LDL
Como a dislipidemia é um dos principais fatores de risco para doenças cardiovasculares, a medicina tem tentado estabelecer, através de estudos, quais são os níveis ideais de colesterol HDL e LDL. Atualmente classificamos os resultados da seguinte maneira:
LDL
- Menor que 100 mg/dL – Ótimo.
- Entre 101 e 130 mg/dL – Normal.
- Entre 131 e 160 mg/dL – Normal/alto.
- Entre 161 e 190 mg/dL – Alto.
- Maior que 190 mg/dL – Muito alto.
HDL
- Menor que 40 mg/dL – Baixo (ruim).
- Entre 41 e 60 mg/dL – Normal.
- Maior que 60 mg/dL – Alto (ótimo).
O que fazer quando o colesterol está alto?
Uma dieta rica em gorduras insaturadas e pobres em gorduras saturadas está indicada para todas as pessoas, independente do valor do seu colesterol. Porém se você tem dislipidemia, seguir esta dieta é ainda mais importante.
Entretanto, nem sempre a dieta sozinha resolve o problema do colesterol alto, isto porque o aumento do LDL está relacionado a fatores genéticos e alimentares. 75% do nosso colesterol é de origem endógena (produzido pelo fígado) e apenas 25% vem da alimentação. Logo, se os valores do LDL forem muito elevados, somente a dieta não será suficiente para normalizar os valores do colesterol ruim. Falamos um pouco mais sobre a dieta para quem tem dislipidemia neste link: Dieta para quem tem colesterol alto.
Exercícios físicos ajudam a elevar o HDL e a diminuir o LDL, sendo outra opção para o controle da dislipidemia. Porém, assim como na dieta, a redução também não é grande. A dieta e os exercícios físicos são suficientes para aqueles pacientes com LDL até 160 mg/dl. Este é o grupo que pode conseguir bons resultados sem ter que recorrer a medicamentos.
A decisão de quando começar os remédios depende não só dos valores de LDL e HDL , mas também da presença de outros fatores de risco para doença cardiovascular, nomeadamente:
PUBLICIDADE / PUBLICIDAD
- Tabagismo.
- Hipertensão.
- Diabetes.
- Insuficiência renal crônica.
- Obesidade e Síndrome metabólica.
- Idade maior que 45 anos.
Quanto mais fatores de risco você tiver, mais baixo devem ser os valores. Grosso modo, podemos resumir da seguinte maneira os alvos:
- Paciente com apenas um fator de risco – Colesterol LDL deve ser menor que 160 mg/dL.
- Paciente com dois ou mais fatores de risco – Colesterol LDL deve ser menor que 130 mg/dL.
- Pacientes com alto risco cardiovascular, principalmente se tiver tido um infarto ou AVC – Colesterol LDL deve ser menor que 100 mg/dL.
Desde 2013, porém, existem novos consensos sobre o tratamento do colesterol alto, que já não dão tanta relevância aos valores de LDL. Em vez de focar num valor alvo de LDL, o tratamento é indicado nos pacientes com risco cardiovascular elevado, mesmo que os valores do LDL não sejam muito elevados. Explicamos em detalhes a nova forma de tratar a dislipidemia no seguinte artigo: Preciso Tomar Remédios Para Baixar o Colesterol?
HDL alto é prejudicial?
Não, pelo contrário. Algumas pessoas, normalmente mulheres, têm HDL muito elevados, às vezes acima de 100 mg/dL. Isso não indica qualquer doença. Na verdade, são pessoas afortunadas pois apresentam baixo risco de doença cardíaca, principalmente se o LDL for baixo.
Portanto, ter HDL alto é bom, pois esta é uma forma de colesterol que nos protege contra a aterosclerose.
O que é colesterol não-HDL?
Colesterol não-HDL é a soma de todos os tipos de colesterol considerados ruins: IDL+LDL+VLDL. Supõe-se que o colesterol não-HDL seja um marcador mais sensível de risco de aterosclerose do que o LDL isoladamente.
Valores do colesterol não-HDL:
- Menor que 130 mg/dL – Ótimo.
- Entre 131 e 160 mg/dL – Normal.
- Entre 161 e 190 mg/dL – Normal/alto.
- Entre 191 e 220 mg/dL – Alto.
- Maior que 220 mg/dL – Muito alto.
Quais são os sintomas do colesterol alto?
Nenhum! Colesterol alto não provoca sintomas.
Atenção: colesterol alto não dá cansaço, dor de cabeça, falta de ar, prostração ou qualquer outro sintoma. A dislipidemia é uma doença silenciosa. A única maneira de saber os níveis de colesterol é através do lipidograma.
Triglicerídeos
A hipertrigliceridemia, nome que se dá ao aumento dos triglicerídeos no sangue, também é fator de risco para aterosclerose, principalmente se associados a níveis baixos de HDL.
Os triglicerídeos estão intimamente ligados ao VLDL e seu valor costuma ser 5x maior. Por exemplo, um indivíduo com VLDL de 30 mg/dL, terá níveis de triglicerídeos ao redor de 150 mg/dL.
PUBLICIDADE / PUBLICIDAD
Os valores normais de triglicerídeos são:
- Até 150 mg/dL – normal.
- Entre 150 e 199 mg/dL – limítrofe.
- Entre 200 e 500 mg/dL – elevado.
- Maior que 500 mg/dL – muito elevado.
A elevação do colesterol e, principalmente, dos triglicerídeos, estão associados a uma maior incidência de acúmulo de gordura no fígado, chamado de esteatose hepática (leia: O que é a esteatose hepática?).
Para saber mais detalhes sobre os triglicerídeos, leia: O que são os triglicerídeos?
Medicamentos usados para o tratamento do colesterol alto (dislipidemia)
Todo paciente com colesterol e/ou triglicerídeo elevado deve se submeter à dieta, praticar exercícios físicos regulares e, se estiver acima do peso, emagrecer.
Os medicamentos de escolha para redução do LDL e aumento do HDL são as estatinas, também chamadas de inibidores da enzima HMG-coA reductase (enzima do fígado responsável pela produção de colesterol). As estatinas também agem na redução dos triglicerídeos.
As estatinas mais prescritas são:
- Sinvastatina.
- Atorvastatina.
- Fluvastatina.
- Pravastatina.
- Rosuvastatina.
- Lovastatina.
- Pitavastatina.
A rosuvastatina e a atorvastatina são as mais fortes e conseguem reduções do colesterol com menores doses. Porém, estas duas são caras e muitas vezes o paciente consegue controle do seu colesterol com as estatinas mais baratas, não sendo preciso usar as drogas mais potentes.
Os principais efeitos colaterais destes medicamentos são a dor muscular e as câimbras. Em alguns casos a lesão muscular pode ser séria e indicar a interrupção do tratamento. Hepatite medicamentosa também pode ocorrer.
Para saber mais sobre as estatinas, leia: Estatinas – Remédios para colesterol alto.
PUBLICIDADE / PUBLICIDAD
Apesar das estatinas agirem nos níveis de triglicerídeos, os fibratos são uma classe com ação mais intensa para esse fim. Os fibratos reduzem os triglicerídeos, mas praticamente não interferem no colesterol LDL.
Os fibratos mais usados são:
- Fenofibrato.
- Bezafibrato.
- Genfibrozila.
- Clofibrato.
- Ciprofibrato.
A associação entre fibratos e estatinas deve ser feita com cautela, uma vez que há aumento do risco de lesão muscular com o uso concomitante dessas drogas.
PUBLICIDADE / PUBLICIDAD